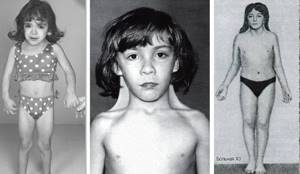
Синдром Шерешевского-Тернера – генетически детерминированная аномалия, характеризующаяся нарушением психофизического статуса, недоразвитием гениталий и низким ростом. Этот врожденный недуг развивается у девочек, имеющих одну половую X-хромосому вместо двух. Характерный кариотип больного человека — 45Х0, но встречаются и иные варианты. Ребенок обычно рождается недоношенным с целым рядом опасных отклонений. Частичная или полная Х-моносомия накладывает отпечаток на всю дальнейшую жизнь больных детей.
Синдром проявляется недоразвитием вторичных половых признаков, молочных желез, гипогонадизмом, наличием аномалий внутренних органов. У пациенток часто полностью отсутствуют яичники и месячные, волосы растут на груди и лице, обнаруживаются врожденные патологии почек, сердца и сосудов, суставные контрактуры, кожные складки на короткой шее, отечные конечности. Больные отстают от своих сверстников в моторном и половом развитии. Внешний вид взрослых женщин отличается грубыми чертами лица, ростом волос по шее до самой спины, широким разрезом глаз, деформацией ушей, Х-образными ногами, низким ростом.
С раннего возраста больные дети чувствуют, что они не похожи на других и осознают свою неполноценность. У девочек вырабатывается комплекс из-за маленькой груди, недостатков фигуры и низкорослости. Но некоторая инфантильность, сохраняющаяся даже в зрелом возрасте, помогает больным легче воспринимать свои изъяны и переносить постоянное психоэмоциональное перенапряжение. Правильный подход к детям с синдромом Тернера помогает им быстрее адаптироваться в обществе, вести полноценную жизнь, дружить, учиться, влюбляться, заводить семьи. Интеллектуальное развитие у большинства из них не имеет отклонений.
Диагностика синдрома основывается на характерных клинических данных и результатах цитогенетического анализа. В настоящее время проводят пренатальную диагностику недуга с помощью УЗИ плода и инвазивных методик. Больных лечат гормональными препаратами, проводят хирургическое восстанавливающее и общеукрепляющее лечение.
Болезнь возникает у представителей всех без исключения рас.
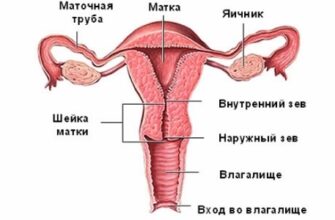
Для синдрома Ульриха-Тернера характерно отсутствие в кариотипе новорожденных одной из половых хромосом.
Первым патологию описал в 1925 году врач-эндокринолог Н. Шерешевский. В 1938 году доктор Г. Тернер выделил основные признаки недуга. В 1959 году Ч. Форд узнал природу нарушения.
Диагностические мероприятия
Диагностикой и лечением синдрома занимаются генетики, гинекологи, неонатологи, педиатры, а также врачи узких специальностей. Прежде всего обращают на себя внимание характерные клинические признаки, имеющиеся даже у новорожденных детей. Синдром со стертой клинической картиной выявляется в пубертатном периоде по отсутствию менархе, недоразвитию половых органов.
Лабораторные и инструментальные методики:
- Гормональное исследование крови – повышение гонадотропинов и снижение эстрогенов.
- Молекулярно-генетическое исследование – изучение кариотипа и определение полового хроматина.
- Цитогенетический анализ и исследование с Y-специфичным зондом — верификация отсутствия Х-хромосомы или ее структурных изменений.
- Пренатальная диагностика заключается в выявлении признаков синдрома у плода по данным УЗИ или инвазивных методов: биопсии хориона, амниоцентеза.
- ЭхоКГ и ЭКГ выявляют пороки сердца.
- МРТ и УЗИ почек.
- Рентгенографическое исследование опорно-двигательного аппарата.
- УЗИ половых органов.
Причины возникновения синдрома Шерешевского-Тернера
Нормальный человеческий кариотип отображается специфической формулой и имеет вид 46, XY (у мужчин) и 46, ХХ (у женщин). Цифра обозначает число молекул ДНК, а буквы – пол человека.
При синдроме Ульриха-Тернера молекул только 45, а одной хромосомы нет. Исследование, позволяющее диагностировать недуг – кариотипирование.
Точная причина нарушения неизвестна.
Выраженность симптомов синдрома Ульриха-Тернера зависит от варианта нарушения. Главными признаками недуга являются несколько патологий.
Кожная складка на шее
Аномалия считается одним частых проявлений заболевания (в 70% случаев). Она имеет вид уплотнения крыловидной формы, которое проходит от затылка к трапециевидным мышцам.
При значительном избытке кожи проявляется видимая, стянутая между головой и плечами, перепонка. Подобный косметический дефект исправляется с помощью несложной операции.
Небольшой рост
У новорожденных с генетическим нарушением длина тела варьируется в пределах 42-45 см. Однако при мозаичной форме аномалии рост может быть нормальным. Развитие происходит с отставанием по женскому типу.
Иногда низкий рост обуславливается нарушением в формировании позвоночного столба (сращением позвонков или деформацией).
«Лицо сфинкса»
Признак может возникать и при других заболеваниях, однако при синдроме Ульриха-Тернера диагностируется в 35% случаев и дополняется шейной кожной патологией.
Симптомы и признаки
У новорождённых с синдромом Тёрнера-Шерешевского наблюдаются следующие симптомы:
Типы нарушений
Существует несколько типов заболевания: мозаичный, с отсутствием одной из половых хромосом (полная моносомия) или изменениями ее структуры. При полной моносомии у плода после 12 недель происходит нормальное развитие яичников. Однако потом начинается замещение фолликулов соединительной тканью, развиваются различные пороки развития.
Полное отсутствие одной из половых хромосом считается самым тяжелым типом синдрома. При нем признаки патологии ярко выражены и с трудом корректируются.
При мозаичном типе нарушения симптомы неспецифичны, хорошо поддаются терапии, и редко вызывают осложнения.
При структурных изменениях кариотип нормальный, но одна хромосома значительно повреждена. Признаки специфической внешности маловыражены.
Этиопатогенетические факторы
Синдром Шершевского-Тернера — наследственная патология, обусловленная отсутствием половой хромосомы, которая, можно сказать, окончательно делает из женщины женщину. Некорректное деление клеток в процессе зачатия приводит к выстраиванию генетического материала с явными нарушениями. К указанному хромосомному дисбалансу ведут неправильно «вставшие» молекулы ДНК.
Недуг также развивается в результате неправильного формирования Х-хромосомы. Причинами ее аномального строения являются:
- потеря участка хромосомы в результате ее разрыва,
- перенес участка хромосомы,
- образование хромосомы в виде кольца,
- прочие хромосомные перестройки — мутации или аберрации.
Мозаицизм имеет большое значение в развитии недуга. У больных в тканях обнаруживают генетически разнородные клетки в различных вариациях. Все эти варианты характерны для женщин. У мужчин синдром возникает крайне редко. Его основными причинами являются транслокация или мозаицизм. Мейотическое расхождение хромосом лежит в основе патологического процесса.
Некорректная хромосомная «сборка» может заключаться в наличии Y-хромосомного элемента в кариотипе. Таким больным удаляют яичники. Это необходимое мероприятие, позволяющее продлить жизнь людям с данным недугом, поскольку Y-хромосомный элемент часто провоцирует развитие раковой опухоли — гонадобластомы.
Кариотипы при данном синдроме:
- Кариотип 45Х0 — замена железистой ткани яичника соединительнотканными тяжами. Нефункционирующие женские железы приводят к необратимому бесплодию. Для продолжения рода прибегают к помощи ЭКО. Этот тип синдрома является самым распространенным и одним из самых тяжелых. Он отличается ярко выраженной симптоматикой и развитием тяжелых осложнений. Синдром с трудом поддается лечению.
- Мозаичный кариотип 45 X0/46 XY – отсутствие матки и недоразвитие влагалища, высокий риск онкологии. Для предупреждения рецидивов болезни показано удаление яичников. Мозаичный кариотип 45 Х0/46 ХХ — ничтожно малые размеры яичников. Беременность возможна при участии донорской яйцеклетки. Мозаичный тип синдрома отличается более легким течением: пороки развития не наблюдаются, симптомов возникает намного меньше и они менее выражены. Недуг хорошо лечится. Мозаичный тип отличается сочетанием двух видов клеток — с нормальным кариотипом и без одной Х-хромосомы. От их пропорционального соотношения будет зависеть состояние здоровья женщины.
В настоящее время ученые установили, что синдром возникает спонтанно. Возраст, наследственность, образ жизни родителей и их вредные привычки не оказывают существенного влияния на формирование аномалии. Возможно деформация хромосомы происходит во время оплодотворения под воздействием патогенных факторов — ионизирующего или рентгеновского излучения, загазованности и загрязненности окружающей среды, сильного электромагнитного воздействия.
Первоначально у эмбриона закладывает нормальное количество половых клеток. В процессе роста и развития плода они подвергаются инволюции. Новорожденная девочка имеет очень мало фолликулов в яичнике или не имеет их вовсе. Кроме дисфункции яичников у больных в процессе эмбриогенеза формируются многочисленные пороки внутренних органов.
Диагностика
При беременности заподозрить недуг можно во время выполнения УЗИ. При синдроме Шерешевского-Тернера появляются некоторые отклонения:
- утолщение воротниковой зоны;
- шейная гигрома;
- расширение почечных лоханок и чашечек;
- деформация костей, формы головы, конечностей;
- сердечные пороки;
- маловодие или многоводие.
ТВП и гигрома заметны уже на первом плановом УЗИ. При мозаичном типе патологии результаты ультразвуковой диагностики остаются нормальными.
Для уточнения формы нарушения рекомендуется кариотипирование плода. Исследование проводится с 10 до 12 недель беременности.
При совершении этой процедуры (под контролем УЗИ) специальной иглой (вводимой в маточную полость через переднюю брюшную стенку) или катетером (через шейку матки), выполняют забор околоплодной жидкости (амниоцентез), крови из сосудов пуповины (кордоцентез) или образца клеток плода (биопсия хориона).
Существует небольшой риск выкидыша (1-2% случаев).
Для уточнения диагноза после врачебного осмотра понадобится выполнение некоторых исследований и диагностических процедур:
- анализ крови на концентрацию половых гормонов;
- денситометрия;
- кариотипирование (если не выполнялось при беременности);
- УЗИ брюшной полости, сердца, почек, органов малого таза;
- рентгенография кистей, локтевых суставов, позвоночника.
Выполняется дифференциальная диагностика с синдромом Ульриха-Нунана, гипофизарным гипогонадизмом, синдромом Майера-Рокитанского-Кюстнера.
Симптоматика
Патология проявляется следующими симптомами:
- Новорожденные имеют массу тела от 2,5 кг до 2,8 кг и длину тела – менее 42-48 см.
- Кожные складки по бокам короткой шеи.
- Лимфедема кистей и ступней с нарастанием лимфатического отека мягких тканей.
- Деформированные ногтевые пластины.
- Нарушение сосательного рефлекса, частые срыгивания, рвота.
- Психомоторное возбуждение.
- Нарушение речи, внимания и памяти.
- Рецидивирующее воспаление среднего уха, формирование кондуктивной тугоухости.
- Низкий рост детей.
- Неправильное телосложение.
- Невыразительная мимика, отсутствие складок на лбу, утолщенная и отвисшая нижняя губа, полуоткрытый рот, деформированные уши, низкий рос волос, необычная форма грудной клетки, микрогнатия и микрогения.
- Атипично сформированные в процессе эмбриогенеза или постнатальном периоде тазобедренные и локтевые суставы, укороченные кости запястья, неправильный контур ног в результате «О»- или «Х»-образной деформации голени, укорочение пальцев рук, сколиоз.
- Частые переломы вследствие остеопороза.
- «Готическое» небо, высокий тембр голоса, аномалии зубов, неправильный прикус.
- Интеллект у больных полностью сохраняется. Дети легко усваивают школьную программу, активно проводят свой досуг, ведут полноценную жизнь.
- Психический статус — инфантильность и эйфория. Психические нарушения проявляются эмоциональной лабильностью, депрессией, неврозами, тревогой и беспокойством.
Лечение
Основными задачами лечения пациенток с синдромом Шерешевского-Тёрнера служат стимуляция роста, индукция формирования вторичных половых признаков и регулярного менструального цикла. В раннем детстве лечение неспецифично — массаж, ЛФК, витамины, полноценное питание, охранительный режим.
С целью увеличения конечного роста назначается рекомбинантный гормон роста (соматотропин) в виде ежедневных подкожных инъекций до достижения пациенткой костного возраста 15 лет и уменьшения скорости роста до 2 см в год. В большинстве случаев ростостимулирующая терапия помогает больным вырасти до 150–155 см. Лечение гормоном роста рекомендуется сочетать терапией анаболическими стероидами.
Для имитации нормального полового созревания с 13-14 лет назначается заместительная терапия эстрогенами, а через 12–18 месяцев циклическая терапия эстроген-прогестагеновыми оральными контрацептивами. Заместительная гормонотерапия проводится до возраста естественной менопаузы у здоровых женщин (примерно до 50 лет). Мужчинам с синдромом Шерешевского-Тернера назначается ЗГТ мужскими половыми гормонами.
При гемодинамически значимых ВПС осуществляется их хирургическая коррекция. Устранение крыловидных складок шеи проводится методами пластической хирургии.
При достижении адекватного уровня полового развития женщины с синдромом Шерешевского-Тернера могут иметь детей с помощью ЭКО, используя донорскую яйцеклетку. При наличии кратковременной овариальной активности возможно использование для оплодотворения собственных ооцитов. Проблема избыточного роста волос решается с помощью эпиляции.
Синдром Мея–Тернера и варикозная болезнь вен органов малого таза у мужчин
А.А. Капто ФГАОУ ВО «Российский университет дружбы народов»; Россия, 117198 Москва, ул. Миклухо-Маклая, 6
Введение
Компрессия левой общей подвздошной вены и фиброзные спайки в ней впервые были описаны немецким патологом R. Virchow в 1851 г. [1]. Он отметил, что глубокие илеофеморальные тромбозы встречались в 5 раз чаще в левой ноге, чем в правой. По данным исследователей [2–5], компрессия левой общей подвздошной вены – широко распространенная патология, которая встречается у 22–50 % населения (без разделения по половому признаку) (табл. 1).
Таблица 1. Частота выявления фиброзных спаек в просвете левой общей подвздошной вены при аутопсиях (без разделения по половому признаку)
| Автор | Год публикации | Количество аутопсий, абс. | Частота выявления спаек, % |
| J.P. McMurrich [2] | 1908 | 57 | 30 |
| W.E. Ehrich, E.B. Krumbhaar [3] | 1943 | 412 | 23,8 |
| R. May, J. Thurner [4] | 1957 | 430 | 22 |
| N. Usui и соавт. [5] | 1978 | 90 | 50 |
В англоязычной литературе синдром компрессии левой общей подвздошной вены чаще называют синдромом Мея–Тернера (May–Thurner syndrome). Бессимптомная компрессия левой общей подвздошной вены у взрослого населения, по данным H.C. Baron и соавт., встречается в 16–20 % случаев [6]. Естественное течение синдрома Мея–Тернера является предпосылкой развития илеофеморального тромбоза и посттромботического синдрома. Развернутая клиническая картина илеофеморального тромбоза у больных с синдромом компрессии левой общей подвздошной вены также называется синдромом Кокетта (Cockett syndrome) [7, 8].
До недавнего времени актуальность проблемы синдрома Мея–Тернера связывали только с его тромботическими осложнениями. При нетромботической компрессии левой общей подвздошной вены развивается клиническая картина, обусловленная полнокровием как внутренней, так и наружной подвздошных вен. Полнокровие внутренней подвздошной вены обусловливает полнокровие вен органов малого таза из-за развития коллатерального кровообращения. Полнокровие наружной подвздошной вены приводит к появлению ретроградного кровотока во впадающей в нее левой кремастерной вене и формированию илеосперматического типа варикоцеле.
Изучение артериовенозных конфликтов как причины варикозной болезни вен органов малого таза у мужчин началось сравнительно недавно. Гипотеза о роли венозного полнокровия органов малого таза в развитии различных урологических заболеваний была высказана еще в 1895 г. немецким урологом K. Posner в его монографии «Диагностика мочеполовых болезней» [9]. В.В. Яковенко (1955) впервые предположил, что причиной развития варикоцеле является венозный застой в мочеполовом сплетении [10]. H. Sakamoto и Y. Ogawa (2008) исследовали взаимосвязь между варикоцеле и венозным сплетением предстательной железы (ПЖ) при помощи скротальной доплерографии и трансперинеальной цветной доплерографии. У всех 209 мужчин, включенных в исследование, диаметр вен простатического сплетения (ПС) положительно коррелировал с диаметром вен правого и левого гроздевидных сплетений. Таким образом авторы установили, что варикоцеле, особенно двустороннее, связано с венозными аномалиями ПЖ [11]. А.И. Неймарк и соавт. (2013) предложили выделять 2 вида варикоцеле: 1) изолированное, при котором отмечаются минимальные нарушения гемодинамики в правом семеннике, а ПЖ не вовлечена в патологический процесс; 2) сочетающееся с тазовой конгестией, при котором нарушения затрагивают не только левое, но и правое яичко, а также ПЖ [12]. Критериями варикозной болезни малого таза у мужчин А.Ю. Цуканов и Р.В. Ляшев (2014) считали диаметр вен парапростатического сплетения >5 мм и/или наличие ретроградного кровотока при пробе Вальсальвы, регистрируемого при дуплексном сканировании вен с использованием ректального датчика [13]. А.А. Капто, О.Б. Жуков (2016) представили первый в мире обзор литературы по варикозной болезни вен органов малого таза у мужчин [14]. В 2017 г. нами предложена ультразвуковая классификация варикозного расширения вен ПС как маркера варикозной болезни вен органов малого таза у мужчин [15].
В настоящее время не существует ни частных, ни общих рекомендаций по диагностике и лечению тазовой венозной конгестии и илеофеморальных сосудистых конфликтов у мужчин с урологической и андрологической патологией. В связи с этим цель настоящего исследования – изучение методов диагностики и лечения подвздошной венозной компрессии у мужчин с урологической и андрологической патологией и варикозной болезнью вен органов малого таза.
Материалы и методы
С 2019 по 2019 г. обследованы 110 пациентов в возрасте от 17 до 69 лет (в среднем 33,2 года) с двусторонним варикоцеле, варикозной болезнью вен органов малого таза и синдромом Мея–Тернера.
Диагноз варикоцеле был верифицирован по данным осмотра и ультразвукового исследования (УЗИ) с доплерографией органов мошонки. В качестве ультразвукового критерия постановки диагноза варикоцеле мы приняли диаметр вен гроздевидного сплетения >2 мм в покое в клиностазе, что отражает общепринятую точку зрения [16–20].
Диагноз варикозной болезни вен органов малого таза был верифицирован при помощи трансректального УЗИ (ТРУЗИ) с использованием критериев и классификации, предложенной нами в 2017 г. (табл. 2) [21].
Таблица 2. Ультразвуковая классификация варикозного расширения вен предстательной железы по А.А. Капто [21]
| Стадия | Определение варикоза | Максимальный диаметр вен, мм | Скорость кровотока, см/с | Скорость кровотока при пробе Вальсальвы, см/с |
| I | Видимый | <4 | <3 | <5 |
| II | Значимый | 5–10 | 3–5 | 5–15 |
| III | Выраженный | >10 | >5 | >15 |
Синдром Мея–Тернера диагностировали при помощи магнитно-резонансной томографии (МРТ) вен с контрастированием. Исследование произведено на магнитно-резонансном томографе GE Opima MR360 (General Electric, США). Для диагностики аортомезентериальной компрессии определяли величину аортомезентериального угла (aortomesenteric angle) (норма 28–65°) и аортомезентериальное расстояние (aortomesenteric distance) (норма 10–34 мм) [22, 23], для диагностики синдрома Мея–Тернера – величину нижнего угла поясничного лордоза (lower lumbar lordosis angle) (норма >134,3°) и диаметр туннеля подвздошной вены (норма >4,2 мм). [24]. Варианты артериовенозных конфликтов илеокавального сегмента оценивали при помощи предложенной нами в 2019 г. классификации (рис. 1) [25].
Рис. 1. Топографо-анатомическая классификация вариантов компрессии подвздошных вен по А.А. Капто [25]. Магнитно-резонансное исследование нижней полой вены и сосудов малого таза (моделирование): а – центральный проксимальный (высокая бифуркация аорты, при которой правая общая подвздошная артерия сдавливает нижний отдел нижней полой вены до ее деления на подвздошные вены); б – центральный дистальный (высокая бифуркация аорты, при которой правая общая подвздошная артерия сдавливает нижний отдел нижней полой вены в месте ее деления на подвздошные вены); в – левый проксимальный (правая общая подвздошная артерия сдавливает левую общую подвздошную вену (синдром Мея–Тернера)); г – левый дистальный (компрессия левой наружной и/или левой внутренней подвздошной артерией левой наружной подвздошной вены); д – правый проксимальный (компрессия правой общей подвздошной артерией правой общей подвздошной вены); е – правый дистальный (компрессия правой наружной и/или правой внутренней подвздошной артерией правой наружной подвздошной вены)
Для диагностики эректильной дисфункции применяли международный индекс эректильной функции (International Index of Erectile Function, МИЭФ-5) [26], проводили доплерографию сосудов полового члена в состоянии покоя и при фармакологически индуцированной эрекции. При подозрении на веногенную эректильную дисфункцию выполняли динамическую фармакокавернозографию, позволявшую верифицировать проксимальный, дистальный и смешанный типы патологического венозного оттока из кавернозных тел полового члена.
У пациентов с урологическими и андрологическими заболеваниями абсолютным показанием к эндоваскулярной операции было сочетание следующих признаков подвздошной венозной компрессии:
- выраженных симптомов со стороны тазовых органов (боли, дизурии, эректильной дисфункции);
- двустороннего и/или рецидивного варикоцеле; 3) варикозного расширения вен ПЖ II–III степени (максимальный диаметр вен ПС >5 мм);
- компрессии подвздошных вен по данным МРТ и флебографии;
- наличие коллатеральных ветвей подвздошных вен по данным флебографии.
Изолированная патоспермия без других клинических проявлений встречалась крайне редко (n = 4) и не рассматривалась как абсолютное показание к ангиопластике и стентированию подвздошных вен.
Оперативное лечение синдрома Мея–Тернера проводилось под местной анестезией в условиях рентгеноoперационной и включало следующие этапы:
- пункцию бедренной или подколенной вены (под ультразвуковым контролем);
- мультипроекционную интраоперационную флебографию;
- баллонную ангиопластику;
- имплантацию стента;
- постдилатацию стентированного сегмента;
- контрольную флебографию.
Пред- и послеоперационное ведение пациента включало:
- антикоагулянтную терапию ривароксабаном в дозе 20 мг/сут в течение 1 нед до операции и 6 мес после нее;
- УЗИ подвздошных сосудов в 1-е сутки после операции, через 2 нед и через 1, 3, 6 мес;
- УЗИ органов мошонки с цветным доплеровским картированием до операции и через 1, 3, 6, 9 и 12 мес после нее;
- ТРУЗИ ПЖ и вен ПС до операции и через 1, 3, 6, 9 и 12 мес после нее;
- оценку состояния пациента с помощью МИЭФ-5, международной шкалы тяжести симптомов при заболеваниях ПЖ (International Prostatic Symptom Score, IPSS) [27], индекса симптомов хронического простатита Национальных институтов здравоохранения США (National Institutes of Health Chronic Prostatitis Symptom Index, NIH-CPSI) [28] до операции и через 1, 3, 6, 9 и 12 мес после нее.
Статистическую обработку результатов провели с помощью статистических пакетов Microsoft Office, программы Excel. Статистическую значимость различий показателей, имеющих нормальное распределение, оценивали по критерию Стьюдента, U-критерию Манна–Уитни.
Результаты
Возраст 110 пациентов, включенных в исследование, варьировал от 17 до 69 лет и в среднем составлял 33,2 года.
Причиной обращения пациентов были боли (внизу живота, в области наружных половых органов, внизу поясницы), дизурия (ирритативная и обструктивная симптоматика), эректильная дисфункция (ухудшение утренних, спонтанных и адекватных эрекций), патоспермия (олиго-, астено- и тератозооспермия), пиоспермия (как маркер воспалительного процесса в ПЖ), рецидивирующий и не поддающийся лечению хронический простатит, двустороннее и рецидивное варикоцеле. Чаще всего пациенты предъявляли жалобы на боли. Из сопутствующих хирургических патологий в большинстве случаев встречались геморрой и варикозное расширение вен нижних конечностей.
Варикоцелэктомия в анамнезе была у 39 пациентов: 1 операция – у 23, 2 – у 9, 3 – у 2, 4 – у 1, 5 – у 1. Из них 15 пациентов были ранее прооперированы нами.
Рис. 3. Стадии синдрома Мея–Тернера по данным магнитно-резонансной томографии нижней полой вены и сосудов малого таза с 3D-реконструкцией: I – компрессия левой общей подвздошной вены; II – компрессия левой общей подвздошной вены с ее дилатацией; III – компрессия левой подвздошной вены со смыканием стенок сосуда в центральной его части и с ее дилатацией; IV – выраженное и протяженное сужение просвета левой общей подвздошной вены
Артериовенозный конфликт диагностировали также с использованием значений аортомезентериального угла, аортомезентериального расстояния, нижнего угла поясничного лордоза и диаметра туннеля подвздошной вены (табл. 3).
Таблица 3. Показатели артериовенозного конфликта по данным магнитно-резонансной томографии вен, n = 110
| Показатель | Минимум | Максимум | Среднее | Норма |
| Аортомезентериальный угол, градусы | 9,6 | 120,6 | 43,6 | 28–65 |
| Аортомезентериальное расстояние, мм | 2,5 | 49,2 | 13,7 | 10–34 |
| Нижний угол поясничного лордоза, градусы | 112,2 | 134,3 | 123,9 | 134,33– 136,76 |
| Диаметр туннеля подвздошной вены, мм | 0,9 | 5,1 | 2,5 | 4,18– 4,50 |
По данным МРТ вен аортомезентериальная компрессия (синдром аортомезентериального пинцета, синдром орехокола, nutcracker syndrome) в сочетании с синдромом Мея–Тернера была диагностирована у 32 (29,1 %) пациентов. Ретроаортальная левая почечная вена (задний синдром орехокола, posterior nutcracker syndrome) в сочетании с синдромом Мея–Тернера была выявлена в 4 (3,6 %) случаях. Сдавление подвздошной вены без сочетания с аортомезентериальной компрессией наблюдалось у 74 (67,3 %) пациентов. Центральный проксимальный артериовенозный конфликт был обнаружен у 4 пациентов, центральный дистальный – у 7, левый проксимальный – у 90, левый дистальный – у 43, правый проксимальный – у 3, правый дистальный – у 5 пациентов. Различные сочетания артериовенозных конфликтов подвздошных сосудов были выявлены в 43 (39,1 %) случаях. Анализ полученных данных позволил нам отметить, что тот или иной конфликт диагностирован у 70 (63,6 %) пациентов, а их сочетанные формы – у 40 (36,4 %) (табл. 4).
Таблица 4. Распространенность различных типов артериовенозных подвздошных конфликтов, n = 110
| Тип конфликта | Число случаев | |
| абс. | % | |
| Левый проксимальный, или синдром Мея– Тернера | 56 | 51 |
| Левый дистальный | 6 | 5 |
| Левый проксимальный + левый дистальный | 32 | 29 |
| Левый проксимальный + правый проксимальный | 2 | 2 |
| Левый проксимальный + правый дистальный | 1 | 1 |
| Центральный проксимальный | 3 | 3 |
| Центральный дистальный | 2 | 2 |
| Центральный дистальный + левый дистальный | 4 | 3 |
| Правый дистальный | 3 | 3 |
| Центральный дистальный + левый дистальный + правый дистальный | 1 | 1 |
| Всего | 110 | 100 |
Жалобы на недостаточную эрекцию предъявляли 78 (70,9 %) из 110 пациентов. Доплерографию сосудов полового члена в состоянии покоя и при фармакологически индуцированной эрекции выполнили у 48 пациентов. В 40 случаях верифицировали веногенную эректильную дисфункцию. Динамическую фармакокавернозографию провели у 22 пациентов; патологический венозный дренаж обнаружили у 18: проксимального типа – у 10, дистального – у 2, смешанного – у 6.
Флебографию как комплексное ангиографическое исследование для выявления артериовенозных конфликтов верхнего (синдрома аортомезентериального пинцета) и нижнего (синдрома Мея–Тернера) уровней выполнили у 41 пациента. Она включала в себя ренокаваграфию и илеокаваграфию с флеботонометрией. Во всех случаях был выявлен синдром Мея–Тернера, а в 12 случаях он сочетался с синдромом аортомезентериального пинцета.
Анализ полученных при флебографии илеокавального сегмента данных позволил нам выделить 4 стадии синдрома Мея–Тернера в зависимости от наличия и выраженности коллатерального кровообращения (рис. 4).
Рис. 4. Стадии синдрома Мея–Тернера по данным илеокаваграфии в зависимости от наличия и выраженности коллатерального кровообращения: I – отсутствие контрастирования вен таза; II – контрастирование вен таза; III – контрастирование вен таза с перетоком контраста в контралатеральную правую общую подвздошную вену; IV – контрастирование вен таза с перетоком контраста в правую общую подвздошную вену и восходящие поясничные вены слева
Мы пришли к выводу, что повышение давления в общей подвздошной вене при выполнении пробы Вальсальвы более чем в 3 раза может указывать на наличие подвздошной венозной компрессии (табл. 5).
Оперативное лечение синдрома подвздошной венозной компрессии осуществили у 26 пациентов. Учитывая то, что фиброзные спайки в сдавленной подвздошной вене встречаются в большинстве случаев, являясь неизбежным патогенетическим звеном этого заболевания, проведение ангиопластики перед стентированием мы считали обязательным (рис. 5). Для баллонной ангиопластики чаще всего мы использовали дилатационные катетеры Atlas Gold PTA Dilatation Catheter (Bard Peripheral Vascular).
Рис. 5. Баллонная ангиопластика (а) и стентирование (б) левой общей подвздошной вены при оперативном лечении синдрома Мея–Тернера
Таблица 5. Результаты флеботонометрии у пациентов с подвздошной венозной компрессией, n = 25
| Вена | Давление, мм рт. ст | Кратность увеличения давления | |
| в покое | при пробе Вальсальвы | ||
| Нижняя полая | 5,25 | 10,35 | 1,97 |
| Правая общая подвздошная | 6,22 | 15,25 | 2,45 |
| Левая общая подвздошная | 8,35 | 26,28 | 3,14 |
С нашей точки зрения, баллонная ангиопластика без других методов неэффективна, а имплантация стента обязательна. Для имплантации мы использовали венозные стенты Wallstent-Uni Endoprosthesis (Boston Scientific) из сплава Elgiloy (на основе никеля, кобальта и хрома). Диаметр и длину стента подбирали в ходе операции. Стент имплантировали таким образом, чтобы его верхняя часть плотно прилегала к стенкам левой общей подвздошной вены, а его верхний край не выходил в просвет нижней полой вены. Устанавливаемые венозные стенты являются самораскрывающимися. Несмотря на это, во всех случаях оперативного лечения синдрома подвздошной венозной компрессии после имплантации стента мы проводили постдилатацию стентированного участка в проксимальном и дистальном отделах. После стентирования выполняли контрольную флебографию и флеботонометрию, которые подтверждали отсутствие компрессии левой общей подвздошной вены, отсутствие коллатерального кровообращения и венной подвздошной гипертензии. Вбольшинстве случаев требовалась имплантация 1 стента, даже если подвздошная венозная компрессия носила сочетанный характер (например, левый проксимальный + левый дистальный конфликты). Однако у 2 пациентов установили по 2 стента: у 1 – в левую общую и левую наружную подвздошную вены, у 1 – в левую и в правую общие подвздошные вены.
Наиболее выраженные изменения жалоб и объективных данных наблюдались к 3-му месяцу после ангиопластики и стентирования (рис. 6). Нами были получены следующие средние значения: МИЭФ-5 до операции – 17,4, через 3 мес после нее – 20,9; IPSS соответственно 21,7 и 15,3; NIH-CPSI – 28,4 и 22,3.
Через 3 мес после ангиопластики и стентирования во всех случаях максимальный диаметр вен ПЖ уменьшился на 20–70 % (в среднем на 45,6 %) по данным ТРУЗИ.
У 13 пациентов с изолированной подвздошной компрессией (без сочетания с синдромом аортомезентериального пинцета) к 3-му месяцу после ангиопластики и стентирования происходила редукция варикоцеле: во всех случаях диаметр левой и правой яичковых вен в клиностазе в спокойном состоянии стал <2 мм.
У 4 пациентов с сочетанием синдрома аортомезентериального пинцета и подвздошной венозной компрессии через 6 мес после ангиопластики и стентирования левой общей подвздошной вены была выполнена двусторонняя варикоцелэктомия из срединного мошоночного доступа по линии Веслинга с положительным результатом.
Обсуждение
B.L. Coolsaet в 1980 г. по результатам ангиографического обследования 67 пациентов выделил 3 типа левостороннего варикоцеле:
- рефлюкс из левой почечной вены во внутреннюю яичковую вену (реносперматический тип);
- рефлюкс из левой общей подвздошной вены в экстрафуникулярные вены, что вызвано обструкцией левой общей подвздошной вены, куда они впадают (илеосперматический тип);
- комбинация первых 2 типов (смешанный тип) [29].
Таким образом, B.L. Coolsaet впервые определил роль подвздошной венозной компрессии, или, в более узком смысле, синдрома Мея–Тернера, в развитии варикоцеле. M.D. Bomalaski и соавт. в 1993 г. впервые описали устойчивое к хирургическому лечению варикоцеле, развившееся вследствие компрессии левой общей подвздошной вены. Этот случай продемонстрировал необходимость отказа от стандартной хирургической техники в таких случаях [30].
Проведенный ранее анализ причин рецидивов варикоцеле у 14 (6,3 %) из 223 пациентов, у которых на протяжении 10 лет выполняли операцию из трансскротального доступа по линии Веслинга, позволил нам верифицировать во всех случаях синдром Мея– Тернера [31]. Вместе с тем в современных клинических руководствах России, Европы и Америки нет указаний на то, что результативность традиционного хирургического лечения может снизиться вследствие синдрома Мея–Тернера.
Консервативных методов лечения синдрома Мея– Тернера не существует. C.A. Binkert и соавт. в 1998 г. впервые опубликовали отчет об успешной ангиопластике и стентировании левой общей подвздошной вены при синдроме Мея–Тернера и тромботической болезни у 8 пациентов (7 женщин и 1 мужчины) [32]. С тех пор в течение 20 лет рентгенохирурги проводят подобное лечение по поводу тромбозов и тромбоэмболии легочной артерии у пациентов с синдромом Мея– Тернера.
Несмотря на то что роль подвздошной венозной компрессии в развитии варикоцеле была определена еще в 1980 г. B.L. Coolsaet, предложившим гемодинамическую классификацию, которой пользуется в настоящее время большинство урологов, до 2019 г. ангиопластика и стентирование у пациентов с урологическими и андрологическими заболеваниями не выполнялись. Первое в мире стентирование левой общей подвздошной вены у пациентов с илеосперматическим типом варикоцеле осуществлено нами 28.03.2017 вМоскве [33]. Спустя 4 мес J.R. Stern и соавт. в Нью-Йорке выполнили стентирование у пациента с варикоцеле, развившимся вследствие синдрома Мея–Тернера [34]. На настоящий момент мы провели ангиопластику и стентирование у 26 пациентов с синдромом Мея–Тернера, илеосперматическим типом варикоцеле и варикозной болезнью вен органов малого таза и получили положительные результаты.
Тактика ведения пациентов с сочетанием синдрома аортомезентериального пинцета и подвздошной венозной компрессии включала следующие этапы:
- флебографию, ангиопластику и стентирование левой общей подвздошной вены;
- оценку состояния скротального и пельвикального венозного полнокровия через 6 мес с целью определения показаний к оперативному лечению варикоцеле.
Во всех случаях уменьшение интенсивности болевого синдрома и его исчезновение положительно коррелировали со снижением выраженности тазовой венозной гиперволемии и уменьшением диаметра вен ПЖ. Это наблюдение позволяет под новым углом рассмотреть проблему хронической тазовой боли и хронического простатита. Устранение венозного полнокровия тазовых органов в результате ангиопластики и стентирования левой общей подвздошной вены сопровождалось улучшением или полным восстановлением эрекции без применения ингибиторов фосфодиэстеразы 5-го типа или проведения какой-либо другой терапии. Это позволило нам оценить веногенную эректильную дисфункцию как составную часть проблемы варикозной болезни вен органов малого таза у мужчин.
Заключение
В настоящей работе представлен первый и самый большой в мире опыт оперативного лечения синдрома илеофеморальной компрессии как причины двустороннего варикоцеле (в том числе рецидивного) и варикозной болезни вен органов малого таза у мужчин.
Анализ полученных данных позволил нам предложить 2 новые классификации: 1) 4 стадии развития синдрома Мея–Тернера по данным МРТ нижней полой вены и сосудов малого таза с 3D-реконструкцией; 2) 4 стадии компрессии левой общей подвздошной вены при синдроме Мея–Тернера в зависимости от наличия и выраженности коллатерального кровообращения при флебографии илеокавального сегмента.
Полученные нами данные свидетельствуют о том, что синдром Мея–Тернера может быть причиной рецидивного варикоцеле. Современный диагностический алгоритм у пациентов с варикоцеле не ориентирован на выявление синдрома Мея–Тернера. Показания к традиционному хирургическому лечению варикоцеле у пациентов с синдромом Мея–Тернера нуждаются в пересмотре.
До недавнего времени диагноз рецидивного варикоцеле вследствие илеофеморальной компрессии, в частности синдрома Мея–Тернера, был для урологов и андрологов «тупиковым» в плане лечения. Наиболее популярная в последнее время операция по J.L. Marmar и соавт. (субингвинальная варикоцелэктомия) [35] не в состоянии решить проблему илеофеморальной компрессии, вторичной тазовой венозной гиперволемии, которая в этом случае с высокой степенью вероятности становится рецидивной.
Ангиопластика и стентирование подвздошных вен при артериовенозных конфликтах – высокоэффективный метод лечения пациентов с варикозной болезнью вен органов малого таза в сочетании с варикоцеле.
Литература
- Virchow R. Uber die Erweiterung Kleinerer Gefasse. Arch Path Anat 1851;3(3):427–9. DOI: 10.1007/BF01960918.
- McMurrich J.P. The occurrence of congenital adhesions in the common iliac veins and their relation to thrombosis of the femoral and iliac veins. Am J Med Sci 1908;135:342–5. DOI: 10.1097/ 00000441-190803000-00004.
- Ehrich W.E., Krumbhaar E.B. A frequent obstructive anomaly of the mouth of the left common iliac vein. Am Heart J 1943;26(6):737–50. DOI: 10.1016/S0002-8703(43)90285–6.
- May R., Thurner J. The cause of the predominantly sinistral occurrence of thrombosis of the pelvic veins. Angiology 1957;8(5):419–27. DOI: 10.1177/000331975700800505. PMID: 13478912.
- Usui N., Muraguchi K., Yamamoto H. et al. . Surgery 1978;40:983.
- Baron H.C., Shams J., Wayne M. Iliac vein compression syndrome: a new method of treatment. Am Surg 2000;66(7):653–5. PMID: 10917476.
- Cockett F.B., Thomas M.L. The iliac compression syndrome. Br J Surg1965;52(10):816–21. PMID: 5828716.
- Cockett F.B., Thomas M.L., Negus D. Iliac vein compression – its relation to iliofemoral thrombosis and the postthrombotic syndrome. Br Med J 1967;2(5543):14–9. DOI: 10.1136/ bmj.2.5543.14. PMID: 6020994.
- Большая медицинская энциклопедия. Под. ред. Н.А. Семашко М.: Советская энциклопедия, 1933. Т. 26. С. 70. .
- Яковенко В.В. Венозные образования яичка, семенного канатика и хирургическое лечение варикоцеле. Реферат дис. … канд. мед. наук. Ленинград, 1955. 15 с. .
- Sakamoto H., Ogawa Y. Is varicocele associated with underlying venous abnormalities? Varicocele and the prostatic venous plexus. J Urol 2008;180(4):1427–31. DOI: 10.1016/j. juro.2008.06.048. PMID: 18710746.
- Неймарк А.И., Попов И.С., Газаматов А.В. Особенности микроциркуляции предстательной железы и гонад у юношей, страдающих изолированным варикоцеле и варикоцеле в сочетании с тазовой конгестией. Экспериментальная и клиническая урология 2013;(2):56–60. .
- Цуканов А.Ю., Ляшев Р.В. Нарушение венозного кровотока как причина хронического абактериального простатита (синдрома хронической тазовой боли). Урология 2014;(4):37–42. [Tsukanov A.Yu., Lyashev R.V. Disorders of venous blood flow as a cause of chronic abacterial prostatitis(chronic pelvic pain syndrome). Urologiya = Urology 2014;(4):37–42. (In Russ.)].
- Капто А.А., Жуков О.Б. Варикозная болезнь малого таза у мужчин (обзор литературы). Андрология и генитальная хирургия 2016;17(2):10–9. .
- Капто А.А. Варикозное расширение вен предстательной железы у пациентов с варикоцеле. Экспериментальная и клиническая урология 2017;(1): 98–103. .
- Wolverson M.K., Houttuin E., Heiberg E. et al. High-resolution real-time sonography of scrotal varicocele. AJR Am J Roentgenol 1983;141(4):775–9. DOI: 10.2214/ajr.141.4.775. PMID: 6604430.
- Rifkin M.D., Foy P.M., Kurtz A.B. et al. The role of diagnostic ultrasonography in varicocele evaluation. J Ultrasound Med 1983;2(6):271–5. https://doi. org/10.7863/jum.1983.2.6.271. PMID: 6876259.
- Gonda R.L. Jr, Karo J.J., Forte R.A., O’Donnell K.T. Diagnosis of subclinical varicocele in infertility. AJR Am J Roentgenol 1987;148(1):71–5. https://dx.doi.org/10.2214/ajr.148.1.71. PMID: 3024475.
- Gerscovich E.O. High-resolution ultrasonography in the diagnosis of scrota1 pathology. I. Normal scrotum and benign disease. J Clin Ultrasound 1993;21(6):355–73. PMID: 8227378.
- Kocakoc E., Serhatlioglu S., Kiris A. et al. Color Doppler sonographic evaluation of inter-relations between diameter, reflux and flow volume of testicular veins in varicocele. Eur J Radiol 2003;47(3):251–6. DOI: https://doi. org/10.1016/S0720-048X(02)00182-1. PMID: 12927671.
- Капто А.А. Варикозная болезнь органов малого таза у мужчин. В кн.: Диагностика и лечение веногенной эректильной дисфункции. Под ред. Д.Г. Курбатовa. М.: Медпрактика-М, 2019. С. 140–166. [Kapto A.A. Varicose disease of the small pelvic organs in men. In: Diagnosis and treatment of venogenic erectile dysfunction. Ed. by D.G. Kurbatov. M.: Medpraktika-M, 2019. Pp. 140–166. (In Russ.)].
- Felton B.M., White J.M., Racine M.A. An uncommon case of abdominal pain: superior mesenteric artery syndrome. West J Emerg Med 2012;13(6):501–2. DOI: 10.5811/westjem.2012.6.12762. PMID: 23358897.
- Vulliamy P., Hariharan V., Gutmann J., Mukherjee D. Superior mesenteric artery syndrome and the “nutcracker phenomenon”. BMJ Case Rep 2013;2013. DOI: 10.1136/bcr-2013-008734. PMID: 23524345. 24.
- Ou-Yang L., Lu G.M. Underlying anatomy and typing diagnosis of maythurner syndrome and clinical significance an observation based on CT. Spine(Phila Pa 1976) 2016;41(21):E1284–91. DOI: 10.1097/BRS.0000000000001765. PMID: 27379417.
- Капто А.А. Эндоваскулярная хирургия подвздошных вен при двустороннем варикоцеле и варикозной болезни вен органов малого таза у мужчин. Урологические ведомости 2018;8(1):11–7. . DOI: 10.17816/ uroved8111-17.
- Rosen R.C., Riley A., Wagner G. et al. The international index of erectile function(IIEF): a multidimensional scale for assessment of erectile dysfunction. Urology 1997;49(6):822–30. PMID: 9187685.
- International Prostate Symptom Score (I-PSS). Available at: https://www.urospec. com/uro/Forms/ipss.pdf.
- Litwin M.S., McNaughton-Collins M., Fowler F.J. J. et al. The National Institutes of Health chronic prostatitis symptom index: development and validation of a new outcome measure. J Urol 1999;162(2):369–75. PMID: 10411041.
- Coolsaet B.L. The varicocele syndrome: venography determining the optimal level for surgical management. J Urol 1980;124(6):833–9. DOI: 10.1016/S0022-5347(17)55688-8. PMID: 7441834.
- Bomalaski M.D., Mills J.L., Argueso L.R. et al. Iliac vein compression syndrome: an unusual cause of varicocele. J Vasc Surg. 1993;18(6):1064–8. DOI: 10.1016/0741–5214(93)90564-3. PMID: 8264037.
- Капто А.А. Трансскротальный доступ по линии Веслинга при оперативном лечении варикоцеле (10-летний опыт применения). Урологические ведомости 2018;8(Спец. вып.):53–4. .
- Binkert C.A., Schoch E., Stuckmann G. et al. Treatment of pelvic venous spur (May–Thurner syndrome) with selfexpanding metallic endoprostheses. Cardiovasc Intervent Radiol 1998;21(1):22–6. DOI:10.1007/ s002709900205. PMID: 9473541.
- Капто А.А., Виноградов И.В., Харпунов В.Ф., Мамедов Р.Э. Рентгенэндоваскулярная ангиопластика и стентирование у мужчины при May– Thurner syndrome. В кн.: Сборник тезисов 12-го Конгресса Профессиональной ассоциации андрологов России. Сочи, 2019. С. 62. .
- Stern J.R., Patel V.I., Cafasso D.E. et al. Left-sided varicocele as a rare presentation of May–Thurner syndrome. Ann Vasc Surg 2017;42:305.e13–6. DOI: 10.1016/j.avsg.2016.12.001. PMID: 28258018.
- Marmar J.L., DeBenedictis T. J., Praiss D. The management of varicoceles by microdissection of the spermatic cord at the external inguinal ring. Fertil Steril 1985;43(4):583–8. PMID: 3987926.
Статья опубликована в журнале «Андрология и генитальная хирургия» выпуск №4 2019, стр. 28-38
Журнал
Андрология и генитальная хирургия 2019 №4
Комментарии
Для отправки комментариев необходимо войти или зарегистрироваться
Прогноз жизни и последствия заболевания
При своевременном установлении диагноза и адекватном проведении лечебных мероприятий прогноз благоприятный. У больных удаётся достичь приемлемого роста и размеров половых органов. Продолжительность жизни при отсутствии тяжёлых анатомических аномалий со стороны других органов не отличается от таковой у здоровых людей. Женщина с синдромом Тёрнера-Шерешевского при нормальном размере матки может забеременеть и выносить ребёнка, воспользовавшись современными репродуктивными методами — оплодотворением яйцеклетки, взятой от донора, в пробирке (ЭКО).
Современные репродуктивные технологии — способ родить здорового ребенка для женщины с генетическим синдромом Тёрнера-Шерешевского
Особенности половой Х-хромосомы
Эта Х-хромосома относится к одной из важнейших в генетическом аппарате клеток. Она наиболее крупная в геноме, в ней содержится до 5% всей информации об организме. Ее утрата – это летальная мутация, так как вместе с нею утрачивается до 1700 генов, которые регулируют определенные жизненные процессы. Нормальные клетки женского тела имеют две Х-хромосомы, одна из них неактивна, образуя особое тельце Барре, со второй активно и постоянно считывается генетическая информация, реализующаяся на уровне женского тела. Если же имеется в наличие одна Х-хромосома, без второй, дублирующей, могу наблюдаться определенные сбои с развитии еще в эмбриональном периоде. Беременность при таком событии может нередко прерываться из-за гибели зародыша, если же ребенок растет и развивается далее, рождается девочка с наличием синдрома Шерешевского.
Установление диагноза
У младенца синдром Шерешевского может выявить неонатолог или педиатр, для этого достаточно провести визуальный осмотр. Указывает на наличие патологии крыловидные складки на шее и отечные конечности. Если явные наружные симптомы отсутствуют, то болезнь обнаруживается в подростковом возрасте по низкому росту, отсутствию первого менструального кровотечения. Кроме того, у больного слабо выражены вторичные половые признаки.
Диагностика обязательно включает анализ на гормоны. Во время исследования обнаруживается увеличение количества гонадотропинов, снижение уровня эстрогенов. Большое диагностическое значение имеет исследование и кариотипа. Обнаружить специфические признаки патологии врач может после акушерского УЗИ. При подозрении на СШТ назначается пренатальная диагностика:
- УЗИ плода показывает, что у него отсутствует носовая кость, увеличена толщина воротникового пространства, недостаточно длинные бедренные или плечевые кости и т. д. Комплексное исследование включает биохимию крови матери на β-ХГЧ, РАРР-А.
- Инвазивные исследования (амниоцентез, биопсия хориона) являются более точными, чем вышеописанный скрининг. Пункцию амниотической оболочки (амниоцентез) и биопсию хориона (зародышевая часть плаценты) чаще всего назначают при повышенном риске рождения ребенка с СШТ, женщинам старше 35 лет, а также при плохих результатах неинвазивных исследований.
Инвазивные исследования проводят только по особым показаниям, они способны с высокой точностью определить патологию.
Больному может понадобиться помощь различных специалистов: генетика, эндокринолога, кардиолога, нефролога, офтальмолога, ЛОР-врача, гинеколога, андролога и т. д.
Чтобы обнаружить врожденные пороки и сопутствующие болезни, назначаются следующие исследования:
- Эхокардиография.
- МРТ сердца.
- Электрокардиограмма.
- УЗИ почек.
- Рентген позвоночного столба, суставов конечностей и остального скелета.
- Денситометрия для проверки плотности костей.
- Гинекологические исследования.
- УЗИ органов малого таза, мошонки и т. д.
Чтобы отличить СШТ от гипофизарного нанизма (задержка физического развития вследствие недостатка соматотропного гормона), нужно провести анализ на гормоны гипофиза, рентген турецкого седла (образование в клиновидной кости черепа), ЭЭГ (электроэнцефалографию).
Психологические проблемы девочек
Важным дефектом, типичным для данного синдрома становятся своеобразные психические изменения, связанные с дефицитом половых гормонов. Они не формируют состояния так называемой психологической зрелости. Не стоит путать это со снижением интеллекта, это несколько иное понятие, обусловленное влиянием гормонов на психику, изменением поведения, обусловленного полом и дальнейшими уже взрослыми отношениями. Для характера и поведения присущи детские повадки, нет серьезности и волевых качеств, способности к самостоятельному решению проблем. Но интеллект при этом не нарушается, способности к обучению вполне адекватные, есть эмоциональная неустойчивость и инфантильность, что создает трудности в самостоятельной взрослой жизни. Добавляются сюда и проблемы закомплексованности, различия внешности со сверстницами существенно давят на психику, что затрудняет адаптацию в обществе и формирует комплексы и стеснение.
Планирование беременности у больных синдромом Шерешевского — Тёрнера
Бесплодность — очень тяжёлый симптом, которым страдают практически все больные синдромом Тёрнера — Шерешевского. В большинстве случаев пациенты не могут иметь детей, однако при мозаичных формах, когда сформирована матка, с помощью метода экстракорпорального оплодотворения (ЭКО) возможно подсадить либо собственную оплодотворённую яйцеклетку (при условии полноценного развития яичников), либо донорскую.
Использование собственных половых клеток женщины возможно только в том случае, если они содержат в себе нормальный кариотип 46 ХХ.
Экстракорпоральное оплодотворение — возможность для женщины с генетическим синдромом Шерешевского — Тёрнера родить здорового ребёнка
Осложнения
Зачастую встречается такое последствие заболевания, как женское бесплодие. Но известны случаи, когда женщины, больные такой болезнью, могут забеременеть – традиционно или при помощи искусственного оплодотворения. Это возможно только у больных с мозаичным вариантом заболевания или в случае раннего гормонального лечения. В основном осложнения связаны с патологиями внутренних органов и систем:
- предрасположенность к раннему развитию заболеваний сердечно-сосудистой системы;
- инфекционно-воспалительные процессы в почках и мочевом пузыре;
- отит;
- возникновение злокачественных новообразований на кожном покрове;
- различные психологические проблемы;
- высокий риск развития сахарного диабета и ожирения.
При своевременной, правильной диагностике и комплексном лечении, люди с таким синдромом полностью адаптируются к жизни. Исключение составляют лица с тяжёлыми врождёнными пороками сердца и сосудов.
Пренатальная диагностика
Ни для кого не секрет, что современные методы диагностики позволяют выявить большинство генетических отклонений плода задолго до рождения. Одну из таких процедур, неинвазивное пренатальное тестирование (скрининг внеклеточной ДНК плода, находящейся в крови матери), можно производить с конца первого триместра беременности.
Преимуществом этой процедуры является то, что она совершенно не опасна для матери и плода. Помимо синдрома Тернера, скрининг внеклеточной ДНК позволяет выявить такие анеуплоидии как синдром Патау (трисомия по 13-й хромосоме), синдром Эдвардса (трисомия по 18-й хромосоме), синдром Дауна (трисомия по 21-й хромосоме), трисомия по Х-хромосоме, синдром Клайнфельтера, синдром Мартина-Белл.
С помощью ультразвукового исследования можно выявить аномалии развития почек и сердца — они относятся к возможным симптомам заболевания.
Синдром можно выявить при помощи амниоцентеза или биопсии хориона. Обе эти процедуры инвазивны и имеют противопоказания. К их достоинствам относится высокая точность полученного результата.
Методы лечения
Гормональная терапия
Основными задачами лечения синдрома Тёрнера-Шерешевского являются достижение приемлемого роста и адекватное течение полового созревания. Первая решается при помощи назначения гормона роста — Соматотропина вплоть до окончательного закрытия хрящевых зон длинных костей верхних и нижних конечностей. С 12-летнего возраста для запуска в организме полового созревания, роста молочных желёз и матки, становления менструального цикла назначаются женские половые гормоны — Эстрогены, затем и Прогестерон. Препараты принимаются женщиной с синдромом Тёрнера-Шерешевского в среднем до 50 лет.
Человеческий гормон роста — основной метод лечения синдрома Тёрнера-Шерешевского
Хирургическое лечение
Оперативное лечение проводится в следующих случаях:
- сопутствующий врождённый порок сердца;
- необходимость коррекции деформации позвоночника;
- коррекция крыловидных складок на шее с косметической целью при помощи методов пластической хирургии;
Немедикаментозное лечение
К немедикаментозному лечению синдрома Тёрнера-Шерешевского относятся следующие мероприятия:
- рациональный режим труда и отдыха;
- диета со сниженным количеством углеводов, обогащённая овощами, фруктами и витаминами;
- лечебный массаж;
- лечебная гимнастика;
- электрофорез и магнитотерапия;
- санаторно-курортное лечение;
Народные средства не доказали свою эффективность в борьбе с данным заболеванием.
Причины
Причины возникновения моносомии по Х-хромосоме связаны с нарушением деления клеток и формирования генетического материала в период внутриутробного развития. Патологические нарушения возникают в ранний период развития плода.
Из-за недостатка или неправильного распределения молекул ДНК нарушается структура отдельных хромосом. При СШТ повреждается Х-хромосома. При классической форме болезни ее нет – 45 ХО (норма – 46ХХ). Из-за дефицита генетического материала развиваются специфические симптомы, которые снижают качество жизни ребенка сразу после появления на свет.
Важно. Синдром Шерешевского-Тернера, в отличие от других хромосомных патологий, не угрожает жизни. Некоторые женщины даже могут забеременеть и родить ребенка.
Медики выделяют следующие предпосылки для возникновения СШТ:
- Инфекционные заболевания перед беременностью или во время нее.
- Воздействие на будущую мать радиации или электромагнитных полей.
- Влияние химических веществ на плод (ранние стадии развития).
- Генетическая предрасположенность.
- Истощение, недостаточное питание во время беременности.
Синдром Шерешевского может развиваться даже при отсутствии вышеописанных факторов.
Патология может развиваться по разным сценариям: вторая хромосома отсутствует полностью, наблюдается частичная моносомия, то есть Х-хромосома отсутствует не полностью, в ней происходят разнообразные перестройки. При СШТ возможен мозаицизм, когда в тканях присутствуют генетически различающиеся клетки.
Моносомия по 45, Х хромосоме – это самый распространенный кариотип. Чаще всего неповрежденная хромосома материнская. Эта разновидность моносомии возникает из-за того, что хроматиды не расходятся вследствие деления клеток в родительской гамете.
При мозаичной форме моносамии (45,Х0/46,ХХ; 45,Х0/46,ХУ и т. д.) часть клеток содержат одну Х-хромосому, а другие – две, при этом вторая может быть Х или У. Эта разновидность патологии имеет более легкое течение.
Болезнь может возникать из-за того, что одна Х-хромосома инактивирована. Как правило, это происходит в период раннего внутриутробного развития. Этот процесс спонтанный и действует на любые пары хромосом, но обычно страдает именно х-хромосома. Некоторые гены избегают инактивации.
У мужчин СШТ возникает вследствие переноса участка хромосомы на негомологичную хромосому или в результате мозаицизма.
Риск развития патологии не зависит от возраста беременной. Количественные, качественные и структурные патологии Х-хромосомы возникают из-за того, что нарушается мейотическое деление хромосом (Х-моносомия) или дробление зиготы (мозаицизм). В большинстве случаев при кариотипе 45,Х0 инактивируется отцовская хромосома.
Из-за отсутствия Х-хромосомы или ее структурных дефектов нарушается формирование половых желез, а также разнообразные аномалии развития.
Практически всегда будущая мать, которая вынашивает плод, имеющий СШТ, страдает от токсикоза, угрозы самопроизвольного аборта или преждевременных родов.
Профилактические мероприятия
Хромосомная патология диагностируется у детей здоровых родителей. Предусмотреть возможность развития синдрома невозможно, как и предпринять какие-либо меры профилактики.
Единственный способ выявить нехватку Х-хромосомы – пройти пренатальную диагностику на начальных сроках беременности. На 11–13 недели женщина может сдать кровь на наличие в ней плазменного протеина А. Это означает повышенную вероятность генетической аномалии. Подтвердить или опровергнуть диагноз можно с помощью биопсии ворсинок хориона. По ним определяют кариотип плода, структуру хромосом.
Если синдром обнаруживается на стадии вынашивания, не нужно паниковать. Девочка может родиться без внешних проявлений заболевания, а недоразвитость половых органов корректируется с помощью гормональной терапии.
Loading…
Поделитесь с друьями!
Наличие функциональных расстройств при синдроме
Помимо внешних дефектов в облике детей с этим синдромом, имеются также и особенности поведения и работы внутренних органов, которые обусловлены наличием только одной Х-хромосомы. Их отмечают сами родители у малышей, начиная с самых первых недель их жизни при уходе. Если говорить о самых частых функциональных дефектах, к ним можно отнести:
- Расстройство рефлекса сосания, связанное с наличием как аномалий в строении зубочелюстного аппарата, так и при проблемах с нервной системой и тонусом мышц лица. Даже при отсутствии аномалий в развитии полости рта и неба, могут возникать неврологические расстройства с проблемами контроля за тонусом мышц лица.
- Приступы общего беспокойства, при котором нет характерных и типичных проявлений, ребенок просто пребывает в возбужденном и беспокойном состоянии длительное время. В целом, кроха плохо спит и не всегда реагирует на голоса родителей, обращенные к ней, может много и беспричинно плакать. По мере развития навыков и созревания нервной системы эти проявления постепенно проходят с возрастом, когда формируются новые рефлексы и навыки.
- Частые и активные срыгивания пищи, возникающие после кормления. Нередко срыгивания возникают через несколько минут или часов после кормления, и нередко подобные проблемы могут указывать на аномалии в строении пищеварительной трубки (резком сужении пищевода, кишечника). Но типичны срыгивания и без каких-либо проблем в строении пищеварительной системы, а только за счет неравномерного сокращения мышц в кишечной трубке, из-за чего страдает перистальтика. Это грозит расстройством прохождения пищевого комка вниз, к толстому кишечнику, что приводит к задержке пищи в желудке и ее срыгиванию. По мерее взросления срыгивания проходят, они сменяются упорными и длительными запорами или их чередованием с поносами.
- Запоздалое формирование речевых навыков связано нередко с задержкой умственного развития или проблемой тонуса мышц в полости рта, что затрудняет освоение речи. Типично подобное для 20% детей.
- Нередко у девочек наблюдается длительное недержание мочи, связанное с нарушением иннервации мочевого пузыря. Нередко проблема энуреза не проходит до школьного возраста и даже подросткового, затем она исчезает.
Необходимые диагностические исследования
Выявить заболевание представляется возможным еще до рождения ребенка, благодаря современным методам генетического анализа. Поэтому все обследования принято делить на пренатальные и постнатальные. К диагностике, используемой до рождения ребенка, относят:
- Кариотипирование будущих родителей, то есть анализ их ДНК. Наличие дефектов в материале матери или отца увеличивает риск развития патологии.
- Хотя при помощи УЗИ и невозможно поставить точный диагноз, оно широко применяется для выявления косвенных проявлений синдрома. Отечность плода, аномалии развития скелета, пороки сердца и другие признаки указывают на формирование генетического заболевания.
- Самым точным является проведение кариотипирования малыша. Для этого применяются различные инвазивные методики, позволяющие получить генетический материал ребенка. Данные процедуры сопряжены с риском инфицирования и прерывания беременности, поэтому решение об их проведении принимается совместно с гинекологом и генетиком.
После появления ребенка на свет поставить диагноз, как правило, не составляет труда. Это связано с тем, что в результате развития синдрома Шерешевского-Тёрнера у пациента формируются специфические симптомы, указывающие на проблему. Для подтверждения наличия заболевания проводятся следующие тесты:
- Анализы крови и мочи используются для определения гормонального статуса малыша, а также оценки работы внутренних органов.
- Для исключения наличия врожденных кардиальных поражений осуществляется УЗИ, в ходе которого делаются своеобразные фото сердца и его замеры, а также ЭКГ.
Разновидности патологии
- отсутствие Х-хромосомы.
Эта форма является наиболее тяжёлой и часто встречающимся вариантом (около 60% случаев заболевания). Она характеризуется полным отсутствием половой хромосомы, что приводит к выраженной классической клинической картине. Генетического материала не достаточно для полноценного развития плода и начиная с 3 месяцев беременности, изначально нормальные яичники претерпевают изменения. Их структура замещается соединительной тканью, у плода появляются пороки развития;
- мозаичная форма.
На этот вариант болезни приходится около 20% от общего числа заболевания. Недуг протекает более благоприятно, поскольку часть клеток имеет нормальный набор хромосом, а значит компенсирует проявления патологии. Внешность девочек с мозаичной формой заболевания может соответствовать классическим проявлениям синдрома, хотя типичные признаки менее выражены. Грубые нарушения в структуре и функции внутренних органов проявляются реже, что значительно облегчает течение недуга;
- нарушения строения Х-хромосомы.
20% больных наследственным синдромом имеют изначально нормальный набор хромосом, но одна из них отличается серьёзными нарушениями структуры молекулы. В таких случаях у женщин наблюдаются признаки, характерные для классической формы заболевания, но выраженность их значительно меньше.
В литературе описаны редкие случаи выявления синдрома Шерешевского-Тёрнера у мужчин. Это объясняется хромосомным мозаицизмом, когда в организме присутствуют клетки с различным набором молекул ДНК.
Связанные нарушения
Симптомы следующих расстройств могут быть сходными с симптомами синдрома Тернера. Сравнения полезны для дифференциальной диагностики.
Синдром Нунана – генетическое заболевание, которое проявляется при рождении (врожденный). Расстройство характеризуется широким спектром симптомов и физических особенностей, которые сильно различаются по диапазону и степени тяжести.
У многих затронутых лиц ассоциированные аномалии включают:
- характерный внешний вид лица;
- широкую или перепончатую шею;
- низкую линию волос;
- типичную деформацию грудной клетки;
- низкий рост.
Характерные аномалии головной и лицевой (черепно-лицевой) области включают:
- широко расставленные глаза (глазной гипертелоризм);
- складки кожи, покрывающие внутренние углы глаз (эпикантальные складки);
- опущенные верхние веки (птоз);
- маленькую челюсть (микрогнатия);
- продавленный корень носа;
- короткий нос с широким основанием;
- низкорасположенные уши (pinnae).
Присутствуют отличительные скелетные мальформации, такие как аномалии грудины, искривление позвоночника (кифоз, сколиоз), наружное отклонение локтей (cubitus valgus). У многих младенцев с синдромом Ноонана есть дефекты сердца, такие как обструкция кровотока из нижней правой камеры в легкие (легочный клапанный стеноз).
Дополнительные аномалии включают пороки развития сосудов, лимфы, плохое свертывание крови, дефицит тромбоцитов, трудности обучения, умеренную интеллектуальную инвалидность, крипторхизм на первом году жизни у пораженных мужчин и другие симптомы.
Узнать больше Признаки диагностика и лечение синдрома Ротора
Синдром Нунан является аутосомно-доминантным генетическим расстройством, вызванным аномалиями (мутациями) четырех основных генов. Некоторые симптомы могут внешне напоминать симптомы синдрома Тернера (низкий рост, перепончатая шея). Однако между этими двумя расстройствами существует много важных различий.
Синдром нунана поражает как мужчин, так и женщин, существует нормальный хромосомный кариотип. Только женщины подвержены влиянию синдрома Тернера, который характеризуется нарушениями, влияющими на Х-хромосому.
Медицинский курьез
Существуют еще два заболевания, которые иногда сокращенно называют синдромами Тернера. Открыли и описали эти патологии однофамильцы американского эндокринолога Генри Тернера, отсюда и путаница с названиями. Это синдромы Мея-Тернера и Персонейджа-Тернера. Оба эти заболевания никак не связаны с моносомией по Х-хромосоме, описанной выше, и даже не являются наследственными болезнями.
Первое описание синдрома Мея-Тернера появилось в 1957 году. Патология проявляется нарушением оттока венозной крови от левой нижней конечности и органов таза, в результате чего больные страдают от постоянных болей в левой ноге и области таза. На поздних стадиях болезни на венографии виден тромбоз глубоких вен. Синдром сложно диагностируется, особенно на ранних стадиях, так как поначалу протекает бессимптомно. Синдром Мея-Тернера обычно начинается в подростковом возрасте, у мужчин встречается чаще, чем у женщин.
В качестве основной диагностической процедуры применяется УЗИ подвздошных вен таза. В случае наличия заболевания, левая общая подвздошная вена в диаметре значительно больше нормальной. Для подтверждения диагноза применяется магнитно-резонансная ангиография подвздошных вен с контрастом. На поздних стадиях болезни лечение проводится хирургически. Часто назначается прием медицинских препаратов, призванных восстановить нормальный кровоток.
Синдром Персонейджа-Тернера в клинической практике встречается редко и его причины до сих пор точно не установлены. Первый сигнал о наличии заболевания — резкая беспричинная боль в плече или руке, реже — в обеих руках одновременно. Многие люди, у которых впервые проявилась эта патология, не считают нужным обращаться за помощью к специалисту, надеясь, что симптомы исчезнут сами.
Боль может не проходить несколько дней, иногда несколько недель. Боль усиливается при движениях и ослабевает, если конечность находится в покое. Многие пациенты перестают разрабатывать руку, из-за чего со временем развивается мышечная дистрофия. У большинства людей заболевание со временем проходит без какого-либо вмешательства. Иногда требуется прием сильных анальгетиков. Причины синдрома Персонейджа-Тернера представляют большой интерес для медиков, но пока не изучены. Распространенность заболевания также не известна.